농도 하강 및 화학적 포텐셜과 탈착 현상: DVS
포스팅 개요
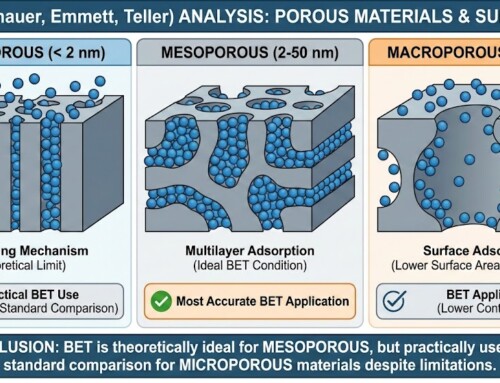
흡착은 기체나 액체 분자가 고체 표면에 달라붙는 현상으로, 환경, 에너지, 화학 등 다양한 분야에서 중요한 역할을 합니다. 특히, 수분이나 이산화탄소(CO2)와 같은 물질의 흡착 및 탈착 과정은 제습, 가스 분리, 포집 기술 등에서 핵심적인 원리입니다. 이 과정에서 ‘농도의 하강’은 ‘탈착’ 현상을 일으키는데요. 그 이유는 화학적 포텐셜(Chemical Potential)이라는 근본적인 열역학적 개념으로 설명될 수 있습니다.
흡착 과정과 농도 변화
물질이 흡착제 표면에 달라붙을 때, 주변 환경(기체상 또는 액체상) 내 해당 물질의 농도는 감소합니다. 이는 분자들이 표면으로 이동하여 포집되기 때문입니다. 이상적인 흡착 환경에서는 평형 상태가 될 때까지 흡착이 진행됩니다.
하지만, 흡착이 일어난 후 주변 환경에서 해당 물질(예: 수분 또는 CO2)의 농도가 낮아지는 상황이 발생하면 흥미로운 현상이 관찰되는데요. 바로 즉시 탈착이 일어난다는 점입니다.
화학 포텐셜의 작용 원리
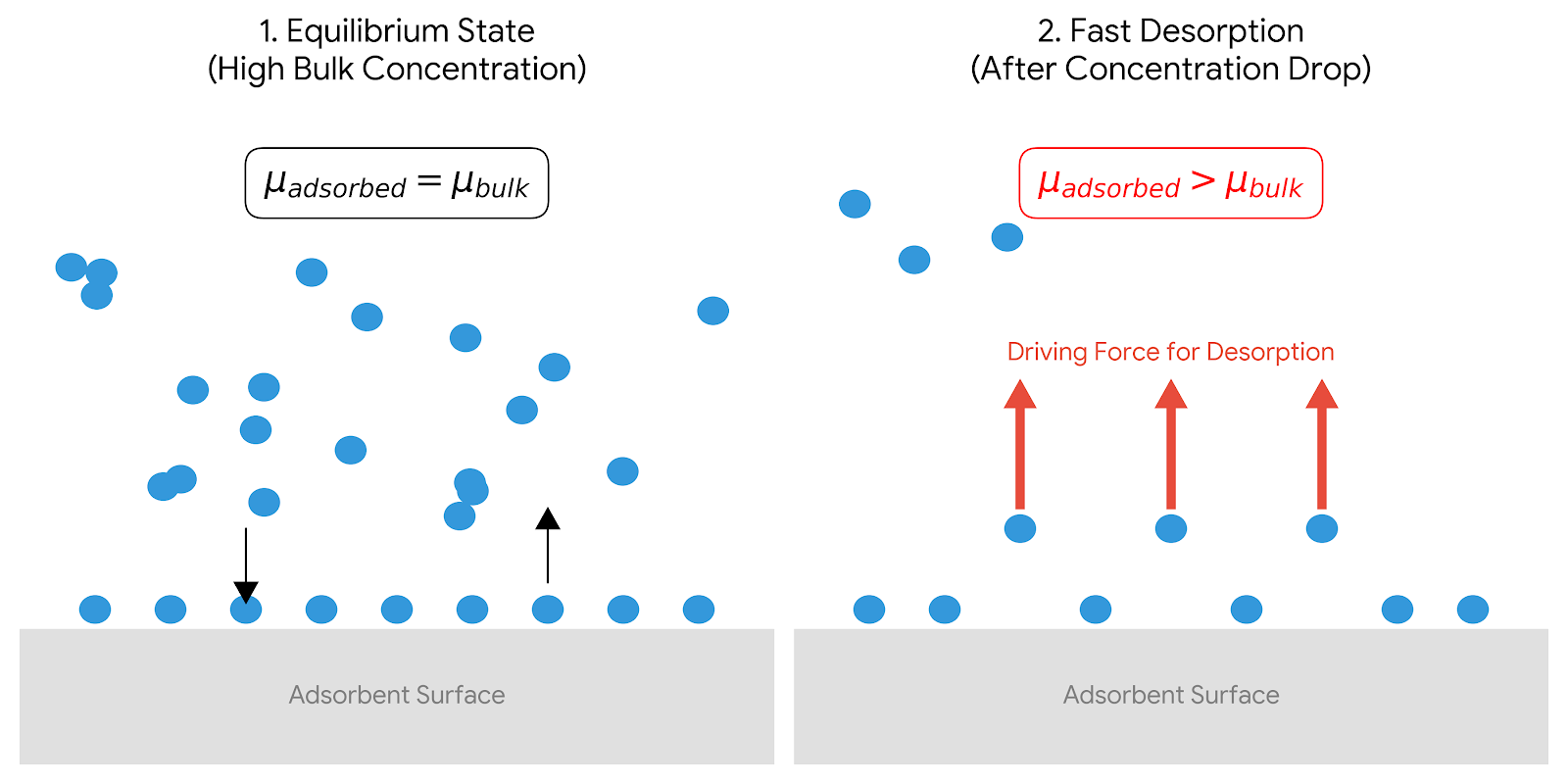
농도 급강하가 빠른 탈착을 유발하는 이유
1. 화학적 포텐셜의 이해
화학적 포텐셜(μ)은 시스템에서 한 물질의 몰(mol)당 자유 에너지 변화를 나타내는 열역학적 양입니다. 쉽게 말해, 물질이 한 상태에서 다른 상태로 이동하려는 경향성을 나타냅니다.
고농도 상태: 화학적 포텐셜이 높습니다. (자유 에너지가 높음)
저농도 상태: 화학적 포텐셜이 낮습니다. (자유 에너지가 낮음)
2. 평형 상태의 흡착제
흡착이 평형에 도달했을 때, 흡착제 표면에 포집된 물질의 화학적 포텐셜(μadsorbed)은 주변 환경의 물질의 화학적 포텐셜(μbulk)과 같습니다.
(μadsorbed) = (μbulk)
3. 농도의 급격한 하강과 불균형
흡착 과정 이후 주변 환경의 농도가 급격히 하강하면, (μbulk)값이 빠르게 낮아집니다.
이 순간, 흡착제 표면에 갇혀있는 물질의 포텐셜이 주변 환경의 포텐셜보다 높아지면서 불균형 상태가 발생합니다.
(μadsorbed) > (μbulk)
4. 빠른 탈착 발생
모든 시스템은 화학적 포텐셜이 높은 곳에서 낮은 곳으로 이동하여 자유 에너지를 최소화하고 새로운 평형 상태에 도달하려는 경향이 있습니다.
따라서, 화학적 포텐셜이 높아진 흡착제 표면의 물질은 급격히 낮아진 주변 환경으로 이동하게 되고, 이는 곧 빠른 탈착(Desorption) 현상으로 나타납니다.
| 상태 | 농도 변화 | 화학 포텐셜 관계 | 결과 |
|---|---|---|---|
| 평형 상태 | 농도 유지 | 흡착제 표면과 주변 화학포텐셜이 균형 유지 | 흡착속도 = 탈착속도 |
| 하강 | 주변 농도 하락 | 흡착제 표면의 화학 포텐셜 > 대기의 화학 포텐셜 물질 높은 곳에서 낮은 곳으로 이동 |
탈착속도 > 흡착속 |
마무리:
수분이나 이산화탄소 흡착 후 농도의 급격한 하강이 빠른 탈착을 유발하는 현상은 단순한 물리적 변화가 아니라, 물질이 더 낮은 자유 에너지 상태로 이동하려는 열역학적 경향, 즉 화학적 포텐셜 차이에 의해 지배됩니다. 이러한 원리를 이해하고 활용하는 것은 고효율의 흡착/탈착 공정을 설계하는 데 필수적입니다.
MCC의 분석 서비스가 궁금하다면?
더 유익한 분석 정보가 필요하다면?